Richiedente: Fondazione SAMIARC
LUOGO DEL PRELIEVO: campioni sigillati e con scheda tecnica della casa produttrice in parte imprintati in loco dall’operatore Sergio Mari e in parte esibiti dal committente (prep. del 4/11/14)
DESCRIZIONE DEI CAMPIONI: bottiglie da 100mL in vetro Pyrex, contenenti una soluzione idroalcolica al 20% in Etanolo denominati dal committente Talita Kum(Biofotoni) e Campioni imprintati con informazione biofotonica di Amoxillina + Acido Clavulanico
METODOLOGIA DI PREPARAZIONE: il committente ha fornito flaconi sigillati sia di acqua distillata che fisiologica, per preparazioni iniettabili, trattati con biofotoni. Inoltre ha inviato confezioni sigillate di alcool trattato con biofotoni. Per ciascuno di questi campioni sono stati forniti anche i relativi controlli (non trattati) sigillati e dello stesso lotto. In laboratorio sono state preparate le soluzioni idroalcoliche utilizzate per le misurazioni.
TABELLA RIASSUNTIVA CALORIMETRICA
| Tipologia Campione: Talita Kum | |||
| Data preparazione | N Campioni | ΔH mescolamento medio: Controllo – campioni | Entità Scostamento |
| 04/11/2014 | 5 | 372 J kg-1 | Significativa |
| 05/12/2014 | 10 | -774 J kg-1 | Molto Significativa |
| 28/01/2015 | 5 | ~0 J kg-1 | Nessuna diversità |
| 31/3/2015 | 5 | -190 J kg-1 | Significativa |
| Tipologia Campione: Amoxicillina + Acido Clavulanico | |||
| Data preparazione | N Campioni | ΔH mescolamento medio: Controllo – campioni | Entità Scostamento |
| 05/12/2014 | 10 | – 20 J kg-1 | Poco significativa |
| 28/01/2015 | 5 | -100 J kg-1 | Significativa |
| 27/02/2015 | 5 | ~0 J kg-1 | Nessuna diversità |
Tabella Riassuntiva Calorimetria
Sono state effettuate misure di: Calorimetria a Miscelazione
DESCRIZIONE DELLA TECNICA
MICROCALORIMETRIA ISOTERMA
In generale per “tecniche calorimetriche” si intendono una serie di tecniche volte a misurare le quantità di calore che si sviluppano in seguito ad un processo chimico.
In particolare, la microcalorimetria isoterma permette di registrare variazioni, anche molto piccole, di entalpia in gioco in vari tipi di processi, come ad esempio, la quantità di calore che viene assorbita (o ceduta) in seguito all’interazione tra due differenti tipologie di molecole.
Le variazioni di entalpia registrate sono molto importanti perché permettono di comprendere il tipo di interazione che si instaura tra molecole.
STRUMENTAZIONE CALORIMETRIA UTILIZZATA
Il calorimetro che è stato utilizzato è chiamato TAM (Thermal Activity Monitor) ed è prodotto dalla Thermometric. In questa tipologia di strumentazione viene sfruttato il principio del flusso di calore: nella cella in cui avviene la reazione, il calore (assorbito o ceduto) viene trasferito ad un “volano termico”, costituito da un blocco di alluminio, mantenuto a temperatura costante. Tra il “volano” e la cella ci sono delle termopile che hanno il compito di registrare e amplificare il segnale come una differenza di potenziale che si stabilisce ai capi delle termopile in seguito alla variazione di temperatura tra volano e cella. Ovviamente questo calore viene registrato da un computer collegato e provvisto di apposito software.
Il TAM, come accennato anche nell’introduzione, permette di registrare i gradienti di temperatura, che si determinano durante i processi, estremamente piccoli, cioè dell’ordine di 10-6 °C, e ciò è possibile anche grazie alla grande stabilità termica dello strumento. Infatti il blocco di alluminio (volano) è immerso in un bagno d’acqua termostatato che assicura la stabilità di temperatura per tempi lunghi e con una precisione di ± 2×10-4 °C, inoltre il laboratorio in cui è posizionato il TAM è mantenuto a temperatura costante (25°C).
Un ultimo accorgimento (basato sul principio delle celle gemelle) permette di minimizzare gli effetti dovuti ad eventuali flussi di calore provocati da effetti esterni alla reazione. Il “cilindro di misura”, infatti, è corredato di una cella in cui avviene la reazione (cella di misura) e di una cella gemella (cella di riferimento). Quest’ultima segue gli eventi termici della cella di misura dovuti a tutte le cause esterne, fatta eccezione per la reazione, ed è collegata con le termopile in opposizione a quelle delle cella di misura. La f.e.m. differenziale che viene misurata è, quindi, in buona misura pulita da effetti esterni e sostanzialmente proporzionale all’evento termico da misurare. La risoluzione massima dello strumento è del decimo di microWatt.
TABELLA 1
| Sistema | -ΔH / J kg-1/dal15 al 19 /01/15 |
| N2 | 1126,8 |
| Contr T33 | 1126,8 |
| 1A | 1126,8 |
| contr 12 | 1081,8 |
| 2A | 1036,7 |
| 3A | 1126,8 |
| 4A | 991,62 |
| 5A | 1104,3 |
| 6A | 1104,3 |
| 7A | 1081,8 |
| 8A | 1081,8 |
| 9A | 1036,7 |
| 10A | 991,62 |
Tabella 1-Amoxicillina+Acidoclavulanico in fisiologicaed EtOH 20% prep del 05/12/2014
TABELLA 2
| Sistema | -ΔH / J kg-1dal 15 al 19/01/15 |
| 2F | 1757,9 |
| 2L | 1938,2 |
| 1L | 1893,1 |
| 1V | 1126,8 |
| CONTR X | 1893,1 |
| 2S | 1081,8 |
| 1T | 1081,8 |
| 2T | 721,18 |
| 3T | 1126,8 |
| 4T | 1081,8 |
| 5T | 1036,7 |
| 6T | 1282,0 |
| 7T | 1240,6 |
| 8T | 1240,6 |
| 9T | 1219,9 |
| 10T | 1199,3 |
Tabella 2- Talita Kum in EtOH 20% prep del 05/12/2014
TABELLA 3
| Sistema | -ΔH / J kg-1/ 29/01/2015 | -ΔH / J kg-1/ 3/03/2015 |
| RIF1 | 1816 | 1778 |
| ADTM1 | 1654 | 1612 |
| ADTM2 | 1303 | 868 |
| ADTM3 | 1943 | 1943 |
| ADTM4 | 2026 | 1984 |
| ADTM5 | 2026 | 1984 |
Tabella 3- Amoxicillina+Acido Clavulanico in EtOH 20% prep del 28/01/2015
TABELLA 4
| Sistema | –ΔH / J kg-1/ 29/01/2015 | -ΔH / J kg-1/ 4/03/2015 |
| RIF1 | 1868 | 1860 |
| TK1 | 1868 | 1860 |
| TK2 | 1868 | 1860 |
| TK3 | 1868 | 1860 |
| TK4 | 1868 | 1860 |
| TK5 | 1868 | 1860 |
Tabella 4- Talita Kum in EtOH 20% prep del 28/01/2015
TABELLA 5
| Sistema | -ΔH / J kg-1/ 2/3/2015 |
| RIF1 | 1860 |
| ADTM1 | 1860 |
| ADTM2 | 1860 |
| ADTM3 | 1860 |
| ADTM4 | 1860 |
| ADTM5 | 1860 |
Tabella 5- Amoxicillina+Acido clavulanico in EtOH 20% prep del 27/02/2015
TABELLA 6
| Sistema | -ΔH / J kg-1/ 01/04/2015 |
| RIF1 | 2398 |
| TK1 | 2191 |
| TK2 | 2357 |
| TK3 | 2109 |
| TK4 | 2109 |
| TK5 | 2274 |
Tabella 6- Talita Kum in EtOH 20% prep del 31/03/2015
TABELLA 7
| Sistema | -ΔH / J kg-1/ 23/03/2015 |
| RIF1 | 1489 |
| TK1 | 1861 |
| TK2 | 1861 |
| TK3 | 1861 |
| TK4 | 1861 |
| TK5 | 1861 |
Tabella 7- Talita Kum in EtOH 20% prep del 4/11/14
CONCLUSIONI:
Il fatto che i dati chimico-fisici, -ΔH / J kg-1 , calore di diluizione, relativi ai campioni siano significativamente diversi da quelli relativi al controllo, che non esibisce variazioni temporali, ma che varia da preparazione a preparazione, segnala una diversità del sistema (soluzione idroalcolica al 20% in Etanolo) probabilmente indotta dai biofotoni emessi dall’operatore di discipline bionaturali (Sergio Mari). Si chiarisce in questa sede che i parametri da prendere in considerazione sono le differenze del calore di diluizione del controllo e quello del sistema sottoposto alla azione dei biofotoni.
Si potrebbe ipotizzare una variazione della struttura sovramolecolare del liquido acquoso, in quanto non sono stati effettuati interventi di tipo chimico. Inoltre il risultato sperimentale che le variazioni del -ΔH / J kg-1, calore di diluizione, rispetto al controllo varino con il crescere dell’età dei campioni, induce a pensare che i campioni analizzati siano da annoverare nella categoria dei sistemi aperti lontano dall’equilibrio. Questi sistemi sono capaci di autorganizzarsi a fronte di perturbazioni di tipo fisico anche di piccole entità energetiche e di creare ordine locale conducendo alla formazione di strutture dissipative nell’accezione della Termodinamica dei processi irreversibili dovuta al premio Nobel (1977) Ilya Prigogine. La vita stessa è il risultato di processi di autorganizzazione spontanei. E’ possibile notare che la presenza di misure non significative è di estrema importanza poiché assicura la certezza che il metodo sperimentale tiene conto anche del fatto che l’imprinting non sia stato applicato correttamente. Alleghiamo un diagramma Potenza/tempo relativo alla misura sperimentale riportata nella tab.1, che evidenzia la significatività delle variazioni sperimentali.
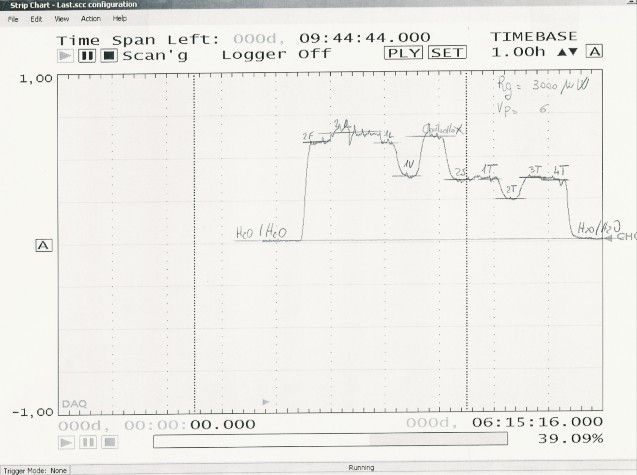
Prof. Vittorio Elia, Napoli, 23 Aprile 2015